- THÔNG TIN THUỐC
THỜI ĐIỂM UỐNG THUỐC MỘT SỐ NHÓM THUỐC SO VỚI BỮA ĂN
Một viên thuốc khi đi vào cơ thể cần trải qua 4 giai đoạn chính là hấp thu, phân bố, chuyển hóa và thải trừ.
Uống thuốc đúng thời điểm để thuốc hiệu quả nhất và hạn chế tác dụng phụ. Thời điểm dùng thuốc tốt nhất là khi đưa vào cơ thể đúng thời điểm thích hợp với nhịp điệu sinh học. Tùy từng bệnh lý, việc sử dụng thuốc theo nhịp sinh học sẽ khác nhau, mỗi loại thuốc lại có thời điểm uống khác nhau.
Sau đây là bảng hướng dẫn thời điểm uống thuốc của một số thuốc trước bửa ăn hoặc sau bửa ăn và một số lưu ý khi dùng thuốc
| Nhóm thuốc | Thuốc | Thời gian
sử dụng |
Chú ý | |
| THUỐC KHÁNG SINH | ||||
| Tetracycline | Doxycycline | 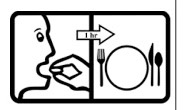 |
– Trước ăn 1h
–Tránh uống cùng với sữa, sữa chua |
|
| Macrolide | Erythromycin
(dạng base hay stearat) |
 |
– Trước ăn 1h
– Nếu bị kích ứng tiêu hóa thì uống cùng bữa ăn |
|
| Roxithromycin | ||||
| Azithromycin |  |
Uống 1h trước hay 2h sau khi dùng thuốc kháng acid | ||
|
Quinolone
|
Ciprofloxacin | 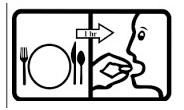 |
-Sau ăn 2h
– Tránh uống cùng với sữa, sữa chua |
|
| Norfloxacin | ||||
| Levofloxacin | ||||
| THUỐC TIÊU HÓA | ||||
| Ức chế bơm proton | Esomeprazole |  |
– Trước ăn 30 phút
– Không được nghiền, bẻ đôi |
|
| Lansoprazole | ||||
| Omeprazole | ||||
| Rabeprazole | ||||
| Pantoprazole | ||||
| Sucralfat | Sucralfat |  |
Trước ăn 30 phút | |
| Chống nôn | Domperidone | |||
| Men vi sinh | Men vi sinh | |||
| Thuốc nhuận tràng |
Sorbitol |
Trước ăn 10 phút | ||
| THUỐC TIM MẠCH | ||||
| Ức chế men chuyển | Captopril |  |
Trước ăn sáng 1h | Tránh thực phẩm chứa Kali: chuối, phomat, thịt bò; thuốc chứa kali… |
| Perindopril |  |
Trước ăn sáng 15 phút | ||
| Imidapril |  |
|||
| Glycoside | Digoxin | 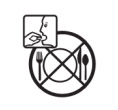 |
Tránh uống thuốc cùng thực phẩm chứa nhiều chất xơ hay cam thảo. | |
| THUỐC XƯƠNG KHỚP | ||||
| Bisphosphonates | Alendronate |  |
Uống trước ăn ít nhất 30 phút, duy trì tư thế đứng hoặc ngồi thẳng lưng ít nhất 30 phút sau khi uống thuốc, uống với nhiều nước | |
| HORMONE | ||||
| Thyroid | Levothyroxin |  |
– Trước ăn sáng 30 phút
– Thận trọng khi dùng các thực phẩm như đậu tương, quả óc chó, thực phẩm chứa nhiều chất xơ. |
|
| THUỐC CHỐNG THIẾU MÁU | ||||
| Ion | Fe(++) |  |
– Trước ăn 1h, không uống viên sắt cùng lúc với các chất giàu canxi (sữa, các chế phẩm về sữa) – Nếu kích ứng tiêu hóa uống sau ăn 2h | |
| THUỐC GLUCO CORTICOID | ||||
| Thuốc Corticoid | Dexamethason |  |
Uống sau ăn | |
| Betamethason | ||||
| Prednisolon | ||||
| Methylprenisolon | ||||
| THUỐC VITAMIN | ||||
| Thuốc Vitamin tan trong dầu | Vitamin A, D, E, K |  |
Uống cùng bữa ăn, hoặc sau bữa ăn để chất béo của thức ăn, đồ uống giúp thuốc hấp thu tốt hơn | |
| THUỐC ĐIỀU TRỊ ĐÁI THÁO ĐƯỜNG | ||||
| Thuốc Biguanid | Metformin |  |
Uống cùng với bữa ăn hoặc sau khi ăn | |
| THUỐC NSAID | ||||
| Diclofenac | Uống sau ăn | |||
| Thuốc chống viêm không steroid | Ibuprofen |  |
||
| Aspirin PH8 | ||||
| Meloxicam | ||||
| Celecoxib | ||||
Giải thích ký hiệu
 Uống thuốc trước bữa ăn
Uống thuốc trước bữa ăn
 Uống thuốc sau bữa ăn
Uống thuốc sau bữa ăn
 Lưu ý KHÔNG sử dụng một số thức ăn khi dùng thuốc
Lưu ý KHÔNG sử dụng một số thức ăn khi dùng thuốc
Tài liệu tham khảo
http://bvydhue.com.vn/c240/t240-564/thoi-diem-uong-thuoc-so-voi-bua-an.html
https://vsh.org.vn/khi-nao-la-thoi-diem-thich-hop-de-dung-thuoc-truoc-sau-hay-cung-voi-bua-an.htm
https://suckhoedoisong.vn/cac-thoi-diem-uong-thuoc-tot-nhat-ban-nen-ghi-nho-169220830151016835.htm
- CẢNH GIÁC DƯỢC
Health Canada: Một số thông tin cập nhật về thuốc điều trị và vắc xin dự phòng COVID-19
Evusheld (tixagevimab và cilgavimab)
Evusheld (tixagevimab và cilgavimab) có thể không hiệu quả đối với một số biến thể phụ của Omicron SARS-CoV-2 khi sử dụng để dự phòng hoặc điều trị COVID-19. Thuốc không có khả năng chống lại một số biến thể của Omicron SARS-CoV-2 như: Omicron BA.2.75.2, BF.7, BJ.1, BN.1, BQ.1, BQ.1.1, và XBB. Dữ liệu này đã được bổ sung vào tờ thông tin sản phẩm của thuốc ở Canada.
Spikevax (Vắc xin COVID-19 Moderna)
Ngày 12/01/2023, Bộ Y tế Canada đã cho phép bổ sung liều Spikevax tăng cường để sử dụng cho thanh thiếu niên (từ 12 đến dưới 18 tuổi). Với trẻ từ 12 tuổi trở lên, liều tăng cường 50 mcg có thể được tiêm bắp sau ít nhất 4 tháng kể từ thời điểm hoàn thành các mũi cơ bản.
Thông tin an toàn Paxlovid (nirmatrelvir và ritonavir) và tái phát COVID-19
Paxlovid (nirmatrelvir và ritonavir) là thuốc kháng virus đường uống dạng phối hợp, được Bộ Y tế Canada cấp phép vào ngày 17/01/2022. Thuốc được chỉ định trong điều trị bệnh COVID-19 thể nhẹ đến trung bình ở người trưởng thành có kết quả dương tính với SARS-CoV-2, và những người có nguy cơ cao tiến triển thành COVID-19 thể nặng, bao gồm cả những trường hợp phải nhập viện hoặc tử vong.
Bộ Y tế Canada đã nhận được báo cáo về các trường hợp tái phát COVID-19 sau khi sử dụng Paxlovid. Tái phát COVID-19 là tình trạng khi người nhiễm COVID-19 đã khỏi bệnh thì các triệu chứng của họ khởi phát trở lại hoặc có kết quả dương tính với virus sau khi đã âm tính. Tái phát COVID-19 có thể là hậu quả của quá trình nhiễm virus SARS-CoV-2 tự nhiên ở một số người và thường ở mức độ nhẹ . Tái phát COVID-19 cũng được ghi nhận ở những người điều trị bằng các thuốc kháng virus SARS-CoV-2 khác và giả dược (placebo) trong các nghiên cứu thử nghiệm lâm sàng điều trị COVID-19.
Tính từ ngày 04/01/2023, Bộ Y tế Canada đã nhận được 23 báo cáo về các trường hợp có khả năng tái phát COVID-19 sau khi sử dụng Paxlovid trong cơ sở dữ liệu cảnh giác dược quốc gia Canada. Bộ Y tế Canada đã đánh giá các báo cáo này cũng như các kết quả từ thử nghiệm lâm sàng và nghiên cứu quan sát. Nhìn chung, không có bằng chứng rõ ràng để xác định sự tái phát COVID-19 là do Paxlovid. Các thông tin hiện có cũng cho thấy sự tái phát COVID-19 không làm thay đổi lợi ích của thuốc Paxlovid, bao gồm giảm tỷ lệ nhập viện hoặc tử vong. Việc sử dụng Paxlovid tiếp tục là một phương pháp điều trị an toàn và hiệu quả đối với những bệnh nhân COVID-19 ngoại trú có nguy cơ cao tiến triển thành thể nặng.
EMA: PRAC bắt đầu đánh giá về tính an toàn của các thuốc chứa pseudoephedrin
Ủy ban Cảnh giác dược của cơ quan quản lý Dược phẩm Châu Âu (PRAC) đã bắt đầu xem xét, đánh giá các loại thuốc có chứa pseudoephedrin sau những lo ngại về nguy cơ gây hội chứng rối loạn tuần hoàn não sau có hồi phục (PRES) và hội chứng co mạch máu não có hồi phục (RCVS) – hai tình trạng tổn thương của mạch máu não sau khi sử dụng các thuốc này. Pseudoephedrin là thuốc dùng đường uống được sử dụng đơn độc hoặc phối hợp với các thuốc khác để điều trị tình trạng nghẹt mũi do lạnh, cảm cúm hoặc dị ứng.
PRES và RCVS có thể làm giảm lượng máu đến não (thiếu máu cục bộ tế bào não) và trong một vài trường hợp có thể dẫn tới các biến chứng nghiêm trọng, đe dọa tính mạng. Các triệu chứng điển hình của PRES và RCVS bao gồm đau đầu, buồn nôn, co giật.
PRAC đã đánh giá thông qua sử dụng dữ liệu mới nhất về các ca gặp PRES và RCVS sau khi sử dụng thuốc chứa pseudoephedrin được ghi nhận trong báo cáo gửi về cơ sở dữ liệu cảnh giác dược và các bằng chứng y văn khác.
Các thuốc chứa pseudoephedrin đã được biết là có nguy cơ gây thiếu máu cục bộ tim và não, bao gồm nhồi máu cơ tim và đột quỵ. Cảnh báo về các nguy cơ trên đã được đề cập trong tờ thông tin sản phẩm của các thuốc nhằm hạn chế những nguy cơ này cho người bệnh khi sử dụng.
PRAC sẽ xem xét mức độ nghiêm trọng của các ca PRES và RCVS, tính an toàn của pseudoephedrin và những chỉ định sử dụng thuốc để từ đó quyết định giấy phép lưu hành thuốc nên được giữ nguyên, thay đổi, đình chỉ hay rút khỏi châu Âu.
Thông tin thêm về thuốc
Pseudoephedrin hoạt động theo cơ chế kích thích thích các tế bào thần kinh giải phóng noradrenalin, có tác dụng làm co các mạch máu. Từ đó giảm lượng dịch thoát khỏi mạch, làm giảm sưng và giảm sản xuất chất nhày tại mũi.
Các thuốc chứa pseudoephedrin được cấp phép tại nhiều quốc gia châu Âu (EU), ở dạng đơn độc hoặc phối hợp với những thuốc khác để điều trị viêm mũi dị ứng hoặc các triệu chứng cảm cúm như đau đầu, sốt, đau nhức ở người bệnh.
Nguồn: https://www.ema.europa.eu/en/news/prac-starts-safety-review-pseudoephedrine-containing-medicines
ANSM: Nguy cơ gây tổn thương thận, đường tiêu hóa, các bệnh về chuyển hóa nghiêm trọng liên quan đến thuốc phối hợp codein-ibuprofen
Thông tin dành cho bác sĩ đa khoa, bác sĩ chuyên khoa thấp khớp, bác sĩ phẫu thuật, bác sĩ sản khoa, bác sĩ phẫu thuật nha khoa, bác sĩ tai mũi họng, bác sĩ gây mê hồi sức, trung tâm điều trị đau, trung tâm vật lý trị liệu và phục hồi chức năng, bác sĩ chuyên khoa thận, bác sĩ tiêu hóa, bác sĩ cấp cứu, nhà thuốc bệnh viện và các dược sĩ cộng đồng.
– Sử dụng chế phẩm phối hợp codein và ibuprofen kéo dài với liều cao hơn liều khuyến cáo, trường hợp bệnh nhân lạm dụng và phụ thuộc vào codein, có thể là nguyên nhân dẫn đến tổn thương thận, đường tiêu hóa và các bệnh về chuyển hóa nghiêm trọng, đôi khi tiến triển gây tử vong với các triệu chứng:
+ Suy thận, hạ kali máu nặng, nhiễm toan ống thận;
+ Thủng, xuất huyết tiêu hóa, thiếu máu nặng.
– Cần xem xét khả năng nhiễm toan ống thận ở những bệnh nhân dùng Antarène Codéine khi có triệu chứng hạ kali máu và nhiễm toan chuyển hóa không rõ nguyên nhân, các triệu chứng có thể bao gồm suy nhược toàn thân và suy giảm ý thức;
– Bệnh nhân cần được lưu ý về:
+ Các nguy cơ của Antarène Codéine
+ Nguy cơ lạm dụng và phụ thuộc thuốc
+ Cần tham khảo ý kiến bác sĩ nếu nhận thấy cần dùng thuốc với liều cao hơn hoặc trong thời gian dài hơn so với khuyến cáo.
Codein-ibuprofen là thuốc phối hợp của hai hoạt chất giảm đau gồm có opioid (codein) và giảm đau kháng viêm không steroid (ibuprofen), khi sử dụng nhiều lần có thể dẫn đến phụ thuộc (nghiện) và lạm dụng codein.
Tại Pháp, Antarène Codéine được bào chế dưới dạng viên nén bao phim với hàm lượng 200 mg/30 mg và 400 mg/60 mg.
Tháng 10/2022, Cơ quan Dược phẩm Châu Âu (EMA) đã kiểm tra tính an toàn của các thuốc phối hợp codein-ibuprofen và ghi nhận một số ca nhiễm độc thận, mắc bệnh về đường tiêu hóa và chuyển hoá. Trong đó, có một số trường hợp tử vong do sử dụng thuốc này kéo dài với liều cao hơn liều khuyến cáo. Hầu hết các ca xảy ra ở các quốc gia nơi bệnh nhân có thể mua Antarène Codéine mà không cần bác sĩ kê đơn. Tại Pháp, tất cả thuốc chứa codein chỉ được cấp phát khi có đơn của bác sĩ, do đó làm giảm nguy cơ xảy ra các tác dụng không mong muốn của codein – ibuprofen.
Tờ tóm tắt các đặc tính của sản phẩm và tờ hướng dẫn sử dụng của Antarène Codéine đang được cập nhật để cảnh báo về các nguy cơ kể trên. Ngoài ra, bệnh nhân cần được thông báo về nguy cơ xảy ra biến chứng khi dùng thuốc và các dấu hiệu nghi ngờ chứng rối loạn sử dụng opioid. Khuyến cáo bệnh nhân liên hệ với bác sĩ nếu những dấu hiệu này xuất hiện.
Trong trường hợp nghiện thuốc, có thể gặp phải hội chứng cai nếu ngừng thuốc, với biểu hiện như bồn chồn hoặc khó chịu.
Health Canada: Apomorphin và nguy cơ thiếu máu tán huyết
Thông tin về nguy cơ thiếu máu tán huyết khi sử dụng Apomorphin đang dần được cập nhật trong các mục cảnh báo và thận trọng (Warnings and Precautions), phản ứng có hại của thuốc (Adverse Reactions) và phần thông tin thuốc dành cho bệnh nhân (Patient Medication Information) trong tờ thông tin sản phẩm chứa Apomorphin tại Canada.
Thông điệp chính dành cho các nhân viên y tế:
- Sau khi thuốc được cấp phép lưu hành, các trường hợp thiếu máu tán huyết cần nhập viện khi điều trị bằng apomorphin đã được ghi nhận, báo cáo.
- Nhiều trường hợp được báo cáo trong đó có xét nghiệm kháng globulin trực tiếp dương tính (test Coombs (+)), gợi ý liên quan đến khả năng tan máu qua trung gian miễn dịch.
- Thiếu máu tán huyết có thể xảy ra ở bất kỳ thời điểm nào sau khi điều trị bằng apomorphin. Nếu bệnh nhân bị thiếu máu trong khi dùng apomorphin, hãy cân nhắc nguy cơ tiến triển của thiếu máu tán huyết. Xem xét ngừng điều trị apomorphin khi xảy ra biến cố này.
Health Canada: Methotrexat và bệnh thiếu máu tán huyết
Methotrexat đã được sử dụng tại Canada từ ngày 31 tháng 12 năm 1955, là một loại thuốc chống chuyển hóa được sử dụng trong điều trị một số loại ung thư. Ngoài ra, methotrexat còn được sử dụng trong điều trị các dạng bệnh vẩy nến nặng hoặc viêm khớp vẩy nến, viêm khớp dạng thấp và viêm khớp dạng thấp seronegative.
Thiếu máu tán huyết là tình trạng các tế bào hồng cầu của người bệnh bị phá hủy nhanh hơn được tạo ra. Xét nghiệm máu thường cho thấy số lượng hồng cầu lưới (hồng cầu chưa trưởng thành) tăng lên và có thể tăng cả nồng độ bilirubin tự do trong huyết thanh, lactate dehydrogenase (LDH), trong khi haptoglobin huyết thanh giảm (hoặc không có).
Thiếu máu tán huyết gây ra do thuốc là một phản ứng có hại rất hiếm gặp nhưng có nguy cơ gây tử vong. Rất khó để xác định chính xác tỷ lệ mắc phải do khó có thể thiết lập được phương pháp chẩn đoán rõ ràng và xác định mối liên quan của phản ứng với một tác nhân cụ thể.
Bộ Y tế Canada đã xem xét theo dõi nguy cơ tiềm ẩn của thiếu máu tán huyết khi sử dụng methotrexat. Từ ngày 23 tháng 11 năm 2022, Bộ Y tế Canada đã nhận được 7 báo cáo về biến cố này nghi ngờ có liên quan đến việc sử dụng methotrexat. Hầu hết các trường hợp không báo cáo thông tin về chỉ định, liều lượng và dạng bào chế được sử dụng. Nhìn chung, các bài báo cung cấp thông tin còn hạn chế để đánh giá và một số có thể bị nhầm lẫn với các thuốc dùng đồng thời đã được biết đến với nguy cơ gây thiếu máu tán huyết.
Các bằng chứng hiện có đến nay còn hạn chế, cần có thêm các báo cáo đầy đủ thông tin chi tiết hơn để đánh giá nguy cơ tiềm ẩn này liên quan đến việc sử dụng methotrexat. Các nhân viên y tế nên báo cáo bất kỳ trường hợp thiếu máu tán huyết nào nghi ngờ có liên quan đến methotrexat để hỗ trợ tiếp tục theo dõi và đánh giá nguy cơ này.
III. THUỐC –MỸ PHẨM ĐÌNH CHỈ LƯU HÀNH
- 1. Căn cứ Công văn số 424/QLD-CL ngày 13 tháng 01 năm 2023 của Cục Quản Lý Dược về Việc thông báo thu hồi thuốc Myomethol (Methylcarbamol 500mg); Thu hồi toàn quốc 11 lô thuốc Viên nén Myomethol ( Methylcarbamol) SĐK:VN-17397-13
Số lô: 49U001, NSX: 12/01/2021, HD: 12/01/2024.
Số lô: 49U002, NSX: 12/01/2021, HD: 12/01/2024.
Số lô: 49U003, NSX: 13/01/2021, HD: 13/01/2024.
Số lô: 49U004, NSX: 13/01/2021, HD: 13/01/2024.
Số lô: 49U005, NSX: 14/01/2021, HD: 14/01/2024.
Số lô: 49U006, NSX: 14/01/2021, HD: 14/01/2024.
Số lô: 49U007, NSX: 15/01/2021, HD: 15/01/2024.
Số lô: 49U008, NSX: 04/02/2021, HD: 04/02/2024.
Số lô: 49U009, NSX: 04/02/2021, HD: 04/02/2024.
Số lô: 49U010, NSX: 05/02/2021, HD: 05/02/2024.
Số lô: 49U011, NSX: 05/02/2021, HD: 05/02/2024
*Lý do không đạt tiêu chuẩn chất lượng về chỉ tiêu tạp chất liên quan Methocarbamol isomer theo qui định tại Dược điển Mỹ (USP 42 ) ( vi phạm mức độ 2)
- Căn cứ Công văn 1223/QLD-CL ngày 10/02/2023 của Cục Quản Lý Dược Dung dịch nhỏ mắt Tobradico(Tobramycin (dưới dạng Tobramycin sulfat ) 15mg/5ml) SĐK:VD-19202-13 Số lô: 0031022 NSX: 02/10/2022 HD: 02/10/2024 Cty SX: Cty Cổ Phần Dược Khoa
*Lý do không đạt tiêu chuẩn chất lượng về chỉ tiêu thử vô khuẩn ( vi phạm mức độ 2)
3.Căn cứ Công văn 1729/QLD-CL ngày 24/02/2023 của Cục Quản Lý Dược
Nexium 40mg (Enterik Kapli Pellet Table) Số lô: 22B264, 21H979
HD: 09/2024 CSSX: Abdi Ibrahim IlacSan.ve TIC A.S Esenyurt/Istanbul
Tetracylin TW3 250mg SĐK:VD-28109-17 Số lô: 0321NSX: 02/02/2021
HD: 02/02/2024 CSSX: Cty CP DP TW 3
Cloro TW3 250mg SĐK:VD-25305-16 Số lô: 0321 NSX: 07/07/2021 HD: 07/07/2024 CSSX: Cty CP DP TW 3
Tobradex (Tobramycin 0.3%, Dexamethason 0.1%) Số lô: 22C10HB NSX: 10/03/2022 HD: 10/03/2024 CSSX: s.a Alcon-Couvreur N.V Rijksweg 14, 2870 Puturs, Bỉ
Tecentriq 1200mg/20ml (atezolimab) Số lô: B0033B03 HD: 02/09/2024
Diamicron MR 30mg (Gliclazid 30mg) Số lô: 695986 HD: 09/2024 CSSX: Les Laboratories Servier industrie Gidy/Fransa
Coveram 5mg/5mg (Peridopril / Amlodipin) Số lô: 2170310010 HD: 11/2024 CSSX: Ilko Ilac, San ve Tic A.S Selcuklu/KONYA
*Lý do Cục Quản lý dược nhận được một số thông tin liên quan đến thuốc giả, nghi ngờ giả của Cơ quan cảnh sát điều tra – Công an huyện Thạch Thất; Công ty TNHH Astrazeneca Việt Nam; Công ty TNHH Novartis Việt Nam; Văn phòng đại diện F. Hoffmann-La Roche Ltd tại Hà Nội; Văn phòng đại diện Les Laboratoire Servier tại Hà Nội về việc phát hiện một số lô thuốc giả, nghi ngờ giả, không rõ nguồn gốc
4.Căn cứ Công văn 2205/QLD-CL ngày 09 tháng 03 năm 2023 của Cục Quản Lý Dược Locobile 200 (Celecoxid 200mg) SĐK:VN-21822-19 Số lô: WLD21003E NSX: 04/02/2021 HD: 03/02/2024 Cty SX: Cty M/s Windlas Biotech (India) sản xuất
*Lý do thu hồi toàn quốc Locobile 200 (Celecoxid 200mg) do không đạt tiêu chuẩn chất lượng về chỉ tiêu đồng đều khối lượng ( vi phạm mức độ 3)
- DANH MỤC THUỐC CẬN HẠN SỬ DỤNG NĂM 2023 TẠI BVĐK TỈNH SÓC TRĂNG
Khoa Dược xin thông báo để các khoa/phòng lưu ý khi sử dụng.
| Stt | Tên Biệt Dược | Tên Hoạt Chất | Dạng | Số lượng | Lô SX | Hạn Dùng |
| 1 | ProIVIG 2,5g/50ml | Immune globulin | Lọ | 43 | 08/2023 | |
| 2 | Ertapenem VCP 1g | Ertapenem | Lọ | 56 | 04/2023 | |
| 3 | BUPIVACAINE AGUETTANT 5MG/ML 0,5%/20ml | Bupivacain hydroclorid | Lọ | 94 | T-8549C | 06/2023 |
| 4 | THẬP TOÀN ĐẠI BỔ | Đương quy, Bạch truật,Đảng sâm, Quế nhục, Thục địa, Cam thảo, Hoàng kỳ, Phục linh, Xuyên khung, Bạch thược | Viên | 55 | 20003 | 07/2023 |
| 5 | Huyết thanh kháng nọc rắn lục tre tinh chế (SAV) 1000LD 50 | Huyết thanh kháng nọc rắn | Lọ | 28 | 041-00-21 | 08/2023 |
Tổ Thông tin thuốc – Dược lâm sàng
 Chat với tư vấn viên
Chat với tư vấn viên Gọi ngay
Gọi ngay
Tin cùng chuyên mục:
LỊCH TRỰC TUẦN TỪ NGÀY 24/11/2025 ĐẾN HẾT NGÀY 30/11/2025
THÔNG BÁO Số 218/TB-BVĐK ngày 21/11/2025 V/v xin báo giá đơn vị tư vấn lập E-HSMT và đánh giá E-HSDT cho các gói thầu thuộc dự toàn Sửa chữa, thay thế linh kiện Máy thở chức năng cao PB980, Máy thở Elisa600, Máy siêu âm tim 3 đầu dò xách tay CX-50; Lắp đặt ngõ ra khí y tế; Mua sắm đầu dò siêu âm tim tại Bệnh viện Đa khoa tỉnh Sóc Trăng
THÔNG BÁO Số 217/TB-BVĐK ngày 21/11/2025 V/v xin báo giá đơn vị tư vấn thẩm định Hồ sơ mời thầu (E-HSMT) và kết quả lựa chọn nhà thầu cho các gói thầu thuộc dự toán Sửa chữa, thay thế linh kiện Máy thở chức năng cao PB980, Máy thở Elisa600, Máy siêu âm tim 3 đầu dò xách tay CX-50; Lắp đặt ngõ ra khí y tế; Mua sắm đầu dò siêu âm tim tại Bệnh viện Đa khoa tỉnh Sóc Trăng
LỊCH TRỰC TUẦN TỪ NGÀY 17/11/2025 ĐẾN HẾT NGÀY 23/11/2025