I. THÔNG TIN THUỐC
1. FDA chấp thuận phối hợp kháng sinh mới imipenem, cilastatin và relebactam
Ngày 17/07/2019, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã chấp thuận Recarbrio (imipenem, cilastatin và relebactam) để điều trị nhiễm khuẩn đường tiểu biến chứng và nhiễm khuẩn ổ bụng cho người trưởng thành.
Recarbrio là một thuốc tiêm phối hợp của ba loại thuốc gồm imipenem-cilastatin, một loại phối hợp kháng sinh đã được FDA chấp thuận trước đây và relebactam, một chất ức chế beta-lactamase mới.
Hiệu lực điều trị của Recarbrio được xác định một phần dựa trên những số liệu về hiệu lực và độ an toàn của imipenem-cilastatin trong điều trị nhiễm khuẩn đường tiểu biến chứng (CUTI) và nhiễm khuẩn ổ bụng (CIAI).
- Vai trò của relebactam trong Recarbrio được đánh giá dựa trên dữ liệu từ các nghiên cứu in vitro và những mô hình động vật bị nhiễm bệnh.
- Sự an toàn của Recarbrio đã được nghiên cứu trong hai thử nghiệm, một thử nghiệm cho CUTI và một thử nghiệm cho CIAI. Thử nghiệm CUTI được tiến hành trên 298 bệnh nhân trưởng thành với 99 bệnh nhân được điều trị với Recarbrio. Thử nghiệm C
- IAI được tiến hành trên 347 bệnh nhân với 117 bệnh nhân được điều trị với Recarbrio.
Các phản ứng có hại thường gặp nhất ở những bệnh nhân được điều trị bằng Recarbrio bao gồm buồn nôn, tiêu chảy, nhức đầu, sốt và tăng men gan.
Không nên sử dụng Recarbrio cho những bệnh nhân đang dùng ganciclovir trừ khi những lợi ích điều trị nhiều hơn nguy cơ, chẳng hạn như sự xuất hiện các cơn động kinh toàn thể đã được báo cáo. Bệnh nhân cũng nên tránh sử dụng Recarbrio khi đang dùng acid valproic hoặc natri divalproex để kiểm soát cơn động kinh vì gây giảm nồng độ acid valproic có thể dẫn đến co giật.
Recarbrio đã được FDA chấp thuận trong quy trình QIDP, dành cho các thuốc kháng khuẩn và kháng nấm dùng điều trị các bệnh nhiễm nghiêm trọng hoặc đe dọa đến tính mạng.
Nguồn: thongtinthuoc.com
2. Tóm tắt báo cáo khoa học về tác động có hại của statin 2019
Hiệp hội Tim Hoa Kỳ vừa công bố bản báo cáo khoa học mới nhằm cập nhật sự an toàn của statin và các biến cố có hại kèm theo. Báo cáo này là một đánh giá toàn diện dựa trên dữ liệu từ các nghiên cứu ngẫu nhiên và nghiên cứu quan sát.
2.1. Các triệu chứng trên cơ
Theo ước tính, bệnh lý liên quan đến cơ (được xác định khi có các triệu chứng trên cơ kèm với nồng độ creatine kinase (CK) ít nhất gấp 10 lần giới hạn trên của mức bình thường) xảy ra với tần suất <1/1.000 bệnh nhân đang điều trị với liều tối đa statin và bệnh lý trên cơ nặng (tiêu cơ vân) xảy ra ở khoảng 1/10.000 bệnh nhân.
* Tỷ lệ xuất hiện các triệu chứng cơ ít nghiêm trọng (đau cơ có hoặc không tăng nhẹ mức CK) rất khó ước tính, do đau cơ rất phổ biến trong dân số nói chung.
2.2. Đái tháo đường
Liệu pháp statin cường độ trung bình và cường độ cao làm tăng nguy cơ tương đối đối với đái tháo đường lần lượt khoảng 10% và 20%, ảnh hưởng đến khoảng 1/100 người sử dụng statin trong suốt 5 năm.
* Tác động gây đái tháo đường của statin liệu có thể đảo ngược được hay không vẫn còn chưa rõ ràng.
2.3. Tác động trên gan
Tỷ lệ xảy ra nhiễm độc gan nặng xấp xỉ 1/100.000 người. Tỷ lệ bệnh nhân có tăng transaminase nhẹ không triệu chứng (thường là thoáng qua) khoảng 1%.
* FDA không khuyến cáo theo dõi thường xuyên nồng độ transaminase ở những người sử dụng statin, mà chỉ theo dõi vào thời điểm trước khi điều trị hoặc khi có chỉ định lâm sàng phù hợp.
2.4. Kết luận về các tác động có hại khác của nhóm statin đã được đề nghị gồm có
* Mặc dù có lợi ích làm giảm tỷ lệ đột quỵ do thiếu máu cục bộ, nhưng dựa trên một số dữ liệu hạn chế: statin được ghi nhận có liên quan đến đột quỵ do chảy máu với tỷ lệ mắc mới hơi cao hơn đối với bệnh nhân có tiền sử bệnh mạch máo não (ví dụ: chảy máu nội sọ). Do đó để thận trọng cần tránh bắt đầu statin ở những đối tượng này; nhưng vẫn có thể tiếp tục statin nếu lợi ích lớn hơn nguy cơ ở bệnh nhân nhập viện vì chảy máu nội sọ.
* Chức năng nhận thức: chưa có bằng chứng xác thực về lợi ích hoặc tác hại.
* Bệnh lý thần kinh ngoại biên: mối liên quan đã được ghi nhận trong các nghiên cứu quan sát, tuy nhiên vẫn chưa được báo cáo trong các thử nghiệm ngẫu nhiên.
* Đục thủy tinh thể: bằng chứng chưa rõ ràng, tuy nhiên đa số cho thấy không có sự gia tăng nguy cơ.
* Chức năng thận: chưa có bằng chứng về bất kỳ tác động nào (ngoại trừ tiêu cơ vân)
* Rối loạn cương dương, viêm gân hoặc đứt gân, ung thư: chưa tìm thấy mối liên quan
Bàn luận
Báo cáo này là sự bổ sung đáng giá cho các tài liệu về tác động có hại của statin. Tài liệu này cũng bao gồm các thông tin hữu ích về tương tác thuốc, dược động học của các statin khác nhau và những vấn đề cần cân nhắc ở người lớn tuổi, trẻ em và những bệnh nhân mắc bệnh thận hoặc gan. Báo cáo kết luận rằng nếu không kèm theo tăng nồng độ CK trên 10 lần thì các triệu chứng có vẻ không phải là bệnh lý cơ liên quan đến statin.
Kinh nghiệm lâm sàng của một số chuyên gia cho thấy triệu chứng trên cơ liên quan đến statin trên các bệnh nhân có nồng độ CK tăng khoảng 2 – 3 lần có thể khỏi sau khi ngưng thuốc. Trên thực tế, những thay đổi bệnh lý về cơ liên quan đến statin đã được ghi nhận khi làm sinh thiết ngay cả ở những bệnh nhân có nồng độ CK bình thường.
Nguồn: thongtinthuoc.com
3. Domperidon: cập nhật giới hạn chỉ định
MHRA: Điểm tin đáng chú ý từ bản tin Drug Safety Update tháng 12/2019
Domperidon không còn được cấp phép để sử dụng cho trẻ dưới 12 tuổi hoặc trẻ dưới 35 kg. Kết quả từ nghiên cứu so sánh với giả dược ở trẻ dưới 12 tuổi mắc viêm dạ dày ruột cấp không chỉ ra sự khác biệt về hiệu quả điều trị nôn, buồn nôn ở nhóm dùng thuốc và nhóm dùng giả dược.
Khuyến cáo cán bộ y tế
Thay đổi chỉ định
– Hiện tại, domperidon chỉ được cấp phép để giảm triệu chứng nôn, buồn nôn ở người lớn và trẻ vị thành niên từ 12 tuổi trở lên và cân nặng từ 35 kg trở lên
– Cân nhắc biện pháp điều trị thay thế domperidon ở trẻ dưới 12 tuổi cần giảm triệu chứng nôn và buồn nôn.
Nhắc lại chống chỉ định
– Các nghiên cứu do cơ quan quản lý dược phẩm tại Châu Âu thực hiện đã chỉ ra rằng một số bác sĩ, trong đó có bác sĩ tại Anh, chưa nắm được thông tin thận trọng quan trọng khi sử dụng domperidion được đưa ra từ 2014
– Chống chỉ định domperidon trong các trường hợp sau:
+ Bệnh nhân suy gan từ trung bình đến nặng.
+ Bệnh nhân có tiền sử khoảng thời gian dẫn truyền tim kéo dài (đặc biệt là khoảng QT).
+ Bệnh nhân có bệnh lý tim như suy tim sung huyết.
+ Bệnh nhân rối loạn điện giải nghiêm trọng.
+ Dùng đồng thời với thuốc kéo dài khoảng QT.
+ Dùng đồng thời với thuốc có khả năng ức chế CYP3A4.
+ Bệnh nhân quá mẫn với domperidon.
+ Bệnh nhân có khối u tuyến yên giải phóng prolactin.
+ Các bệnh nhân có nhu động dạ dày bị kích thích có thể gặp phản ứng có hại do domperidon (ví dụ, bệnh nhân xuất huyết dạ dày-ruột, tắc ruột hoặc thủng ruột).
Nhắc lại khuyến cáo về liều dùng và thời gian điều trị
– Với bệnh nhân người lớn và trẻ vị thành niên từ 12 tuổi trở lên và cân nặng từ 35 kg trở lên, liều khuyến cáo tối đa trong 24 giờ là 30 mg (cách dùng: 10 mg/lần có thể dùng tới 3 lần/ngày).
– Sử dụng domperidon với liều thấp nhất có hiệu quả trong khoảng thời gian ngắn nhất và thời gian điều trị không nên quá 1 tuần.
– Báo cáo phản ứng có hại nghi ngờ cho cơ quan quản lý.
Nguồn: canhgiacduoc.org.vn
II. CẢNH GIÁC DƯỢC
1. Phản ứng có hại của thuốc cản quang chứa iod
Trong giai đoạn từ năm 2012 đến nay, Trung tâm DI & ADR Quốc gia đã ghi nhận một số báo cáo điển hình liên quan đến phản ứng dị ứng với thuốc cản quang chứa iod, bao gồm các báo cáo phản ứng từ mức độ nhẹ (ban đỏ, mày đay, mẩn ngứa, sốt, rét run) cho đến mức độ nghiêm trọng đe dọa tính mạng như sốc phản vệ, ngừng tim, ngừng thở. Số lượng báo cáo nghiêm trọng qua các năm có xu hướng liên tục tăng cho thấy cần có biện pháp tích cực hơn nữa để giám sát và quản lý các yếu tố nguy cơ trong quá trình sử dụng thuốc cản quang nhằm phòng ngừa những hậu quả đáng tiếc có thể xảy ra.
Các phản ứng có hại liên quan đến thuốc cản quang có chứa iod
Có nhiều cách phân loại phản ứng có hại của thuốc cản quang, bao gồm phân loại dựa trên cơ chế sinh lý bệnh (phản ứng dạng dị ứng/quá mẫn và phản ứng dạng độc tính hóa học), dựa trên hệ cơ quan chịu ảnh hưởng (phản ứng liên quan đến thận và phản ứng không liên quan đến thận) và dựa trên thời gian khởi phát (phản ứng cấp tính và phản ứng xuất hiện muộn). Áp suất thẩm thấu là một trong những tác nhân chính liên quan đến phản ứng quá mẫn cấp tính (immediate hypersensitivity reactions – IHR):
– Phản ứng IHR mức độ từ nhẹ đến trung bình xảy ra trong khoảng từ 5% đến 13% lượt tiêm thuốc cản quang ion hóa có áp suất thẩm thấu cao và từ 0,2% đến 3% lượt tiêm thuốc cản quang không ion hóa có áp suất thẩm thấu thấp.
– Phản ứng nghiêm trọng đe dọa tính mạng cấp tính xuất hiện với tỷ lệ từ 0,04% đến 0,22% lượt tiêm thuốc cản quang ion hóa có áp suất thẩm thấu cao và từ 0,004% đến 0,04% lượt tiêm thuốc cản quang không ion hóa có áp suất thẩm thấu thấp.
Chi tiết những phản ứng thường gặp và các yếu tố nguy cơ được tóm tắt trong bảng 1.
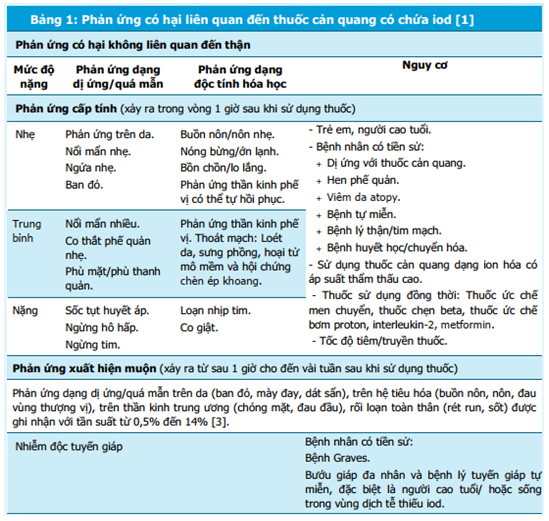

MLCT: Mức lọc cầu thận
Trong cơ sở dữ liệu báo cáo ADR của Trung tâm DI & ADR Quốc gia từ năm 2006 đến hết năm 2017 có tổng số 1037 báo cáo liên quan đến thuốc cản quang chứa iod, thông tin được trình bày trong bảng 2.
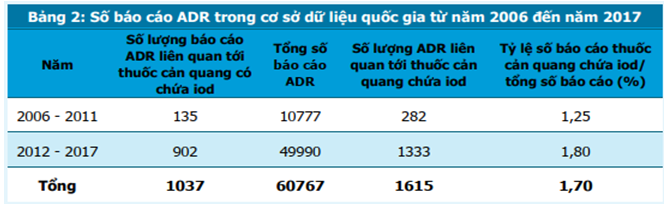
Số lượng báo cáo ADR liên quan đến thuốc cản quang giai đoạn 2012-2017 gấp 6,68 lần số lượng báo cáo giai đoạn 2006-2011. Tỷ lệ báo cáo về thuốc cản quang trong cơ sở dữ liệu qua hai giai đoạn này tăng từ 1,25% lên 1,80%.
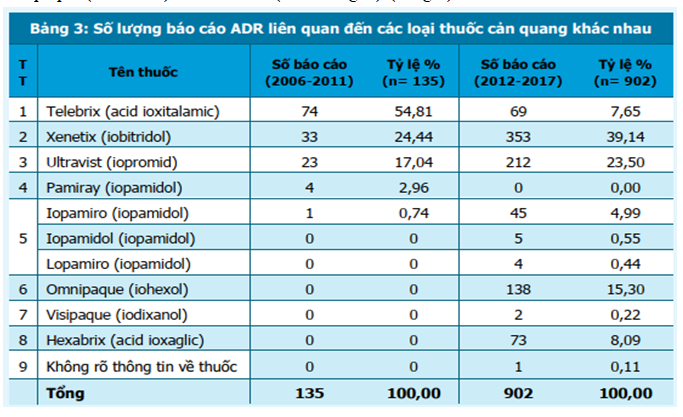
Trong giai đoạn 2006-2011, biệt dược Telebrix (acid ioxitalamic) được báo cáo nhiều nhất (chiếm 54,81%), sau đó là Xenetic (iobitridol) chiếm 24,44% và Ultravist (iopromid) chiếm 17,04%. Sang đến giai đoạn 2012-2017, Xenetic (iobitridol) và Ultravist (iopromid) có số lượng báo cáo lớn nhất (lần lượt chiếm 39,14% và 23,50%), sau đó là Omnipaque (iohexol) chiếm 15,30%. Cơ sở dữ liệu cũng đã ghi nhận báo cáo với các thuốc cản quang khác như Pamiray (iopamidol), Iopamiro (iopamidol), Visipaque (iodixanol) và Hexabrix (acid ioxaglic) (bảng 3).
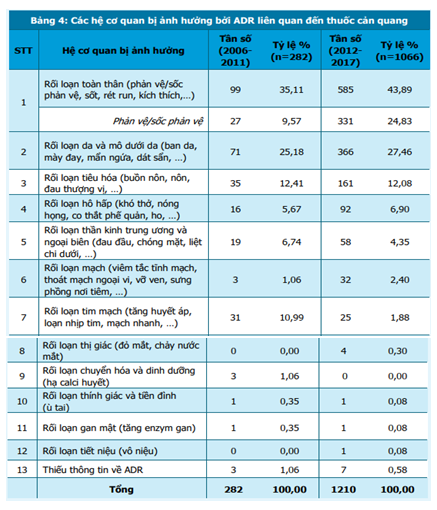
Trong giai đoạn 2006-2017, rối loạn toàn thân được báo cáo nhiều nhất với tỷ trọng ngày càng tăng lên (từ 35,11% lên 43,89%), trong đó tần suất của phản ứng phản vệ/sốc phản vệ đã tăng từ 9,57% lên 24,83%. Rối loạn da và mô dưới da là ADR phổ biến thứ hai sau rối loạn toàn thân, chiếm từ 25,18% (2006-2011) đến 27,46% (2012-2017) tổng số báo cáo liên quan đến thuốc cản quang. Rối loạn tiêu hóa và rối loạn hô hấp lần lượt chiếm các vị trí tiếp theo. Cơ sở dữ liệu cũng ghi nhận một số phản ứng ít gặp khác như hạ calci huyết, tăng men gan, ù tai,… (bảng 4).
Trong khi tổn thương thận là phản ứng có hại đã được ghi nhận trong y văn thì hệ thống báo cáo tự nguyện chỉ thu được 01 trường hợp vô niệu. Để tìm hiểu rõ hơn về tần suất xuất hiện của phản ứng này, Trung tâm DI & ADR Quốc gia đã phối hợp với 2 cơ sở điều trị thực hiện hoạt động giám sát tích cực tổn thương thận liên quan đến thuốc cản quang trên bệnh nhân. Kết quả cho thấy tổn thương thận xảy ra trong khoảng từ 6,1% [6] đến 7,1% [7] số bệnh nhân sử dụng thuốc cản quang, trong đó tỷ lệ bệnh thận do thuốc cản quang có ý nghĩa lâm sàng là 1,1%.
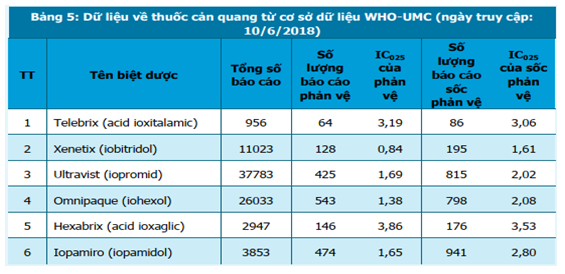
Khi tra cứu cơ sở dữ liệu phản ứng có hại của Tổ chức Y tế Thế giới (Vigibase) đặt tại Trung tâm giám sát thuốc quốc tế UMC – WHO tính đến 10/6/2018, khả năng gây ra ADR sốc phản vệ của thuốc cản quang Xenetix (iobitridol), Ultravist (iopromid) và Telebrix (ioxitalamat), Omnipaque (iohexol), Hexabrix (acid ioxaglic) và Iopamiro (iopamidol) so với các thuốc khác là khác biệt có ý nghĩa thống kê (IC025 >0) (bảng 5).
Các yếu tố nguy cơ
Có nhiều yếu tố nguy cơ làm tăng tần suất xuất hiện ADR liên quan đến thuốc cản quang đã được ghi nhận trong y văn, bao gồm các yếu tố về đặc điểm thuốc cản quang, các yếu tố về cơ địa người bệnh, các yếu tố về bệnh lý mắc kèm và thuốc dùng kèm, các yếu tố về thực hành lâm sàng của cán bộ y tế. Chi tiết yếu tố nguy cơ của từng loại phản ứng xin xem bảng 1.
Xử trí và dự phòng ADR do thuốc cản quang chứa iod gây ra
Để phòng ngừa các phản ứng có hại liên quan đến thuốc cản quang, cần thận trọng khi sử dụng thuốc trên các đối tượng bệnh nhân có nguy cơ, đặc biệt đối với bệnh nhân nghi ngờ có bệnh lý thận. Bên cạnh đó, cần khai thác kỹ tiền sử dị ứng của bệnh nhân và luôn chuẩn bị trang thiết bị để sẵn sàng xử trí các phản ứng cấp tính.
Hiện nay có nhiều protocol dự phòng phản ứng có hại của thuốc cản quang sử dụng các thuốc chống dị ứng như corticoid, kháng histamin nhưng hiệu quả của chúng vẫn còn đang tranh cãi. Để giảm thiểu tác hại trên bệnh nhân thì việc xử trí kịp thời sốc phản vệ đóng vai trò rất quan trọng. Năm 2018, Hiệp hội Chẩn đoán hình ảnh niệu sinh dục châu Âu (ESUR) đã có cập nhật về hướng dẫn xử trí cho các trường hợp phản vệ với thuốc cản quang chứa iod (bảng 6).

Tại Việt Nam, Bộ Y tế cũng đã cập nhật phác đồ xử trí cấp cứu sốc phản vệ (Thông tư số 51/2017/TT-BYT ngày 29/12/2017) với các biện pháp cơ bản là ngừng dùng thuốc, cho bệnh nhân nằm tại chỗ, tiêm bắp adrenalin dung dịch 1/1000 và các thuốc chống dị ứng đặc hiệu khác; thở oxy, bù nước, chất điện giải (nếu cần).
Kết luận
Trong vòng 6 năm trở lại đây, các báo cáo ADR liên quan đến thuốc cản quang chứa iod, đặc biệt là các báo cáo nghiêm trọng có xu hướng tăng lên. Tín hiệu nguy cơ và mối liên quan giữa việc sử dụng thuốc cản quang và phản ứng sốc phản vệ trên bệnh nhân đã được ghi nhận từ cơ sở dữ liệu của Việt Nam cũng như từ cơ sở dữ liệu của Tổ chức Y tế Thế giới. Do vậy, việc xây dựng và triển khai quy trình quản lý và sử dụng thuốc cản quang tại các cơ sở khám, chữa bệnh cũng như cập nhật hướng dẫn xử trí sốc phản vệ đóng vai trò quan trọng giúp giảm thiểu các tai biến liên quan đến thuốc cản quang trong thực hành.
Trong khi hiệu quả của việc dự phòng các ADR do thuốc cản quang vẫn chưa được chứng minh rõ ràng, cán bộ y tế cần chú ý khai thác tiền sử, thận trọng với các đối tượng có nguy cơ cao, đồng thời chuẩn bị sẵn sàng bộ cấp cứu sốc phản vệ cũng như kỹ năng xử trí sốc phản vệ trước khi sử dụng các thuốc này.
Nguồn: canhgiacduoc.org.vn
2. Sử dụng chất cản quang ở bệnh nhân đái tháo đường đang điều trị Metformin
Khuyến cáo trước đây
Do có khả năng đào thải qua thận, metformin được khuyến cáo thận trọng khi kê toa cho các đối tượng đang bị hoặc có nguy cơ suy thận. Theo FDA, metformin bị chống chỉ định khi nồng độ creatinin (Cr) ở nam > 1.5 mg/dL, ở nữ > 1.4 mg/dL và với bất kỳ đối tượng nào có độ thanh thải Cr bất thường. Việc tích lũy metformin trong suy thận có thể dẫn đến nhiễm toan lactic nguy cơ gây tử vong cao, nhưng các đánh giá lâm sàng hệ thống lại phát hiện rằng, metformin tự nó không liên quan đến việc tăng nguy cơ nhiễm toan lactic hay tăng nồng độ lactat, thậm chí ở những người đang bị bệnh thận (độ lọc cầu thận ước tính [eGFR] 30-60 mL/phút/1.73 m2).
Tình trạng nhiễm toan lactic ở bệnh nhân đang điều trị metformin không nhất thiết do metformin gây ra, có khả năng là do tình trạng tiềm ẩn như nhiễm khuẩn máu. Vì vậy, vào năm 2012, ADA/EASD đã đưa ra khuyến cáo giảm mức chống chỉ định dùng metformin xuống còn < 30 mL/phút/1.73m2 (thay vì eGFR < 60 mL/phút/1.73m2 như trước đây) và cần giảm liều khi eGFR < 45 mL/phút/1.73m2.
Quan ngại về nhiễm toan lactic do metformin khi bị bệnh thận do chất cản quang (CIN), FDA và các hướng dẫn năm 2013 từ ACR khuyến cáo rằng ngưng sử dụng metformin trong 48 giờ sau khi sử dụng chất cản quang và chức năng thận nên được đánh giá lại trước khi tiếp tục dùng metformin, thậm chí đối với những bệnh nhân có chức năng thận bình thường ở mức nền; nhưng trong hầu hết các trường hợp, sự kiểm tra lại Cr sau khi dùng chất cản quang đường tiêm tĩnh mạch IV không được tiến hành.
Một số nghiên cứu liên quan
Parra và cộng sự đã nghiên cứu 97 cựu chiến binh – những người đã thực hiện tổng cộng 111 xét nghiệm X-quang trong 27 tháng. Dân số bệnh nhân này có tỷ lệ cao các bệnh lý đi kèm, và 30% trong số đó có eGFR < 60 mL/phút/1.73 m2. Kết quả không có sự khác biệt đáng kể về chỉ số Cr trước và sau khi dùng chất cản quang. Tuy nhiên, có 4 bệnh nhân (eGFR ~ 60-70 mL/phút/1.73 m2) đã phát triển CIN – Cr trong huyết thanh tăng ít nhất 25%, nhưng không diễn tiến nhiễm toan lactic, chức năng thận đã trở lại mức nền trong vòng 2 tuần.
Gần đây nhất, Gómez-Herrero đã nghiên cứu 98 bệnh nhân bị đái tháo đường đang điều trị metformin, từng chụp CT tăng tương phản (CECT Scan) và sử dụng biện pháp ngăn ngừa nhiễm toan lactic theo như khuyến cáo. Kết quả, không có bất cứ bệnh nhân nào với eGFR > 60 mL/phút/1.73m2 diễn tiến CIN; với eGFR < 60 mL/phút/1.73m2 có 1/21 bệnh nhân (4.7%) diễn tiến CIN. Họ kết luận, nguy cơ bị CIN ở bệnh nhân có chức năng thận bình thường là rất nhỏ và vì vậy, chỉ những người có chức năng thận bất thường mới nên ngưng điều trị metformin khi đang sử dụng chất cản quang.
Hơn nữa, theo nghiên cứu tổng quan của McCartney cho thấy 17/18 trường hợp nhiễm toan lactic do metformin liên quan chất cản quang là ở những bệnh nhân bị rối loạn chức năng thận.
Nhiều trường hợp được báo cáo nhiễm toan lactic do metformin không phải do sự tích lũy metformin mà là do các tình trạng thiếu oxy liên quan (suy tim; suy gan giai đoạn cuối).
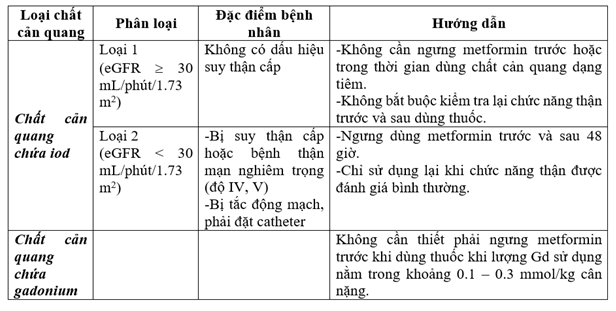
Tóm tắt khuyến cáo mới
Kết luận
Với hướng dẫn mới từ ACR, nếu bệnh nhân không có bất cứ nguy cơ điển hình nào của suy thận cấp và chức năng thận bình thường hoặc có eGFR ≥ 30 mL/phút/1.73m2, không cần thiết phải ngưng metformin trước và sau khi dùng thuốc cản quang đường tiêm, và không bắt buộc phải kiểm tra chức năng thận sau đó.
Nguồn: thongtinthuoc.com
3. Bảng câu hỏi Tầm soát nguy cơ cho bệnh nhân được chỉ định CTScanner có tương phản

III. TỔNG KẾT HOẠT ĐỘNG BÁO CÁO PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR) NĂM 2019 TẠI BVĐK TỈNH SÓC TRĂNG
Bảng 1. BÁO CÁO TỔNG HỢP CÁC PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR)
| STT | Tên khoa phòng/ TYT xã | Tổng số báo cáo ADR |
Số báo cáo ADR nghiêm trọng |
| 1 | Nội 1 | 02 | 01 |
| 2 | Nội 2 | 01 | 00 |
| 3 | Ngoại Tổng Quát | 01 | 00 |
| 4 | Cấp cứu tổng hợp | 01 | 00 |
| 5 | Nhiễm | 01 | 00 |
| 6 | Răng hàm mặt | 02 | 00 |
| 7 | Cấp Cứu tổng hợp | 03 | 00 |
| 8 | Nội 1 | 01 | 00 |
| 9 | Ngoại CTCH | 01 | 00 |
| 10 | Chẩn đoán hình ảnh | 01 | 01 |
| Tổng cộng | 14 | 02 |
BẢNG 2. BÁO CÁO CHI TIẾT CÁC TRƯỜNG HỢP ADR TẠI CƠ SỞ
| STT | Số ADR tại cơ sở | Tên thuốc nghi ngờ gây ADR | Mô tả phản ứng/ tên triệu chứng | Biến cố nghiêm trọng | ||||
| 1 | 2 | 3 | 4 | 5 | ||||
| 1 | 01 | VOLTAREN 75mg/3ml (Diclofenac) | Tê môi | Ngứa da toàn thân | Lo âu, hốt hoảng | 01 | ||
| 2 | 01 | ACTILYSE 50mg ( Alteplase) | Lạnh run | Vã mồi hôi | Thở phù phù | Tiếp xúc chậm | HA: 80/60 mmgHg | 00 |
| 3 | 01 | VAMMYBIVID’S 1g (Vancomycin) | Tê môi | Đỏ bừng mặt | Vã mồ hôi | Tim nhanh 120 lần/phút | HA: 110/70 mmgHg | 00 |
| 4 | 01 | LEFLOCIN 150ml (Levofloxacin) | Nổi mẩn đỏ | Ngứa toàn thân | 00 | |||
| 5 | 01 | HUYẾT THANH KHÁNH ĐỘC TỐ UỐN VÁN TINH CHẾ (SAT) 1500 UI/ML | Khó thở | Mệt | Vã mồ hôi | HA:80/50mmHg | 00 | |
| 6 | 01 | CEFOTAXONE 1G ( cefotaxim) | Vã mồ hôi | Chi lạnh | Mạch nhanh nhỏ khó bắt | 00 | ||
| 7 | 02 | CEFOTAXONE 1G ( cefotaxim) | Ngứa toàn thân | Nổi mề đay | Da đỏ | 00 | ||
| 8 | 02 | OMNIPAQUE ( Iohexol ) | Ngứa toàn thân | Mẫn đỏ | Mặt đỏ, phù | 00 | ||
| 9 | 01 | CEFTRIAXONE (Ceftriazon 1g) | Mẩn đỏ | Đỏ toàn thân | Thở nhanh | 00 | ||
| 10 | 01 | OMNIPAQUE ( Iohexol ) | Người tím tái | Ngừng tim | 01 | |||
| 11 | 02 | VAMMYBIVID’S 1g (Vancomycin) | Ngứa toàn thân | Nổi mề đay | 00 |
* Cefotaxim 1g có 3 ca ADR.
* Vancomycin 1g có 3 ca ADR.
* Omnipaque có 3 ca ADR, trong đó có 1 ca nghiêm trọng.
Ngày 07/03/2020 có 1 ca ADR thuốc cản quang Xenetix ở mức độ nhẹ. Phản ứng có hại của thuốc cản quang cần được thảo luận và xem xét một cách chặt chẽ nhằm đảm bảo an toàn người bệnh.
IV. THUỐC – MỸ PHẨM ĐÌNH CHỈ LƯU HÀNH
Công văn số 838/QLD-CL ngày 22/01/2020 của Cục Quản lý Dược về việc đình chỉ lưu hành thuốc không đạt tiêu chuẩn chất lượng Viên nén bao phim Buclapoxime (Cefpodoxime Proxetil Tablets USP 200 mg) SĐK: VN-17278-13, số lô BCT1018003; HD: 09.10.2020 do Công ty Brawn Laboratories Ltd. (Ấn Độ) sản xuất, Công ty TNHH Nutri Pharma US nhập khẩu. Mẫu thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu hàm lượng, lô thuốc được xác định là vi phạm mức độ 3.
V. AN TOÀN NGƯỜI BỆNH
KHÓA NGAY – BÁO GẤP CHO NHÂN VIÊN Y TẾ KHI:
- Khó thở
- Run, vã mồ hôi
- Mệt, nôn ói
- Nổi mề đay, ngứa
- Xúc kim truyền
- Sưng, đau nơi truyền
- Có bọt khí trong dây truyền dịch
- Dịch truyền không chảy
- Hết dịch truyền
3 KHÔNG
- Không tự ý di chuyển một mình trong lúc truyền dịch.
- Không tự ý chỉnh tốc độ dịch truyền.
- Không tự rút kim truyền.
3 NÊN
| Nên đi vệ sinh trước khi truyền dịch. |
| Nên nằm tại giường trong lúc truyền dịch. |
| Nên nhờ sự giúp đỡ của NVYT, người thân khi di chuyển. |
 Chat với tư vấn viên
Chat với tư vấn viên Gọi ngay
Gọi ngay
Tin cùng chuyên mục:
LỊCH TRỰC TUẦN TỪ NGÀY 17/11/2025 ĐẾN HẾT NGÀY 23/11/2025
THÔNG BÁO Số 208/TB-BVĐK ngày 12/11/2025 V/v xin báo giá đơn vị cung cấp dịch vụ sửa chữa thiết bị y tế tại Bệnh viện Đa khoa tỉnh Sóc Trăng
THÔNG BÁO Số 200/TB-BVĐK ngày 11/11/2025 V/v xin báo giá đơn vị cung cấp dịch vụ sửa chữa thiết bị y tế tại Bệnh viện Đa khoa tỉnh Sóc Trăng
THÔNG BÁO Số 194/TB-BVĐK ngày 07/11/2025 V/v khảo sát giá lập dự toán mua sắm, sửa chữa thiết bị y tế năm 2026 tại Bệnh viện Đa khoa tỉnh Sóc Trăng